Организация производства и контроля качества на предприятиях группы компаний «Р-Фарм», которая выступает партнером V Всероссийской GMP-Конференции с международным участием, основывается на гармонизации российских и европейских требований GMP.
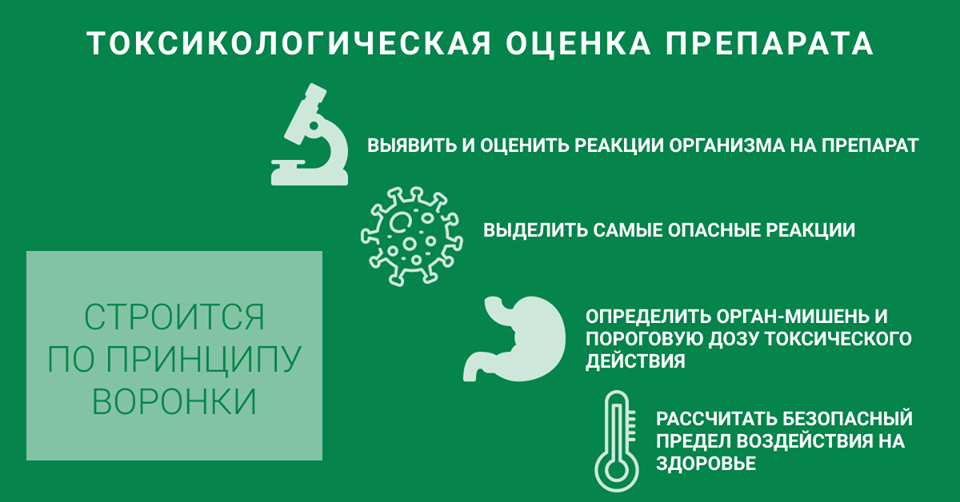
Благодаря этому, к моменту вступления в силу Решения Совета Евразийской экономической комиссии от 03.11.2016 № 77 «Об утверждении Правил надлежащей производственной практики Евразийского экономического союза» предприятия «Р-Фарм» были готовы к изменениям. Одно из них – это необходимость проведения токсикологической оценки лекарственных средств при совмещении производства препаратов на одних и тех же технологических линиях. Токсикологическая оценка лекарственных средств при совмещении производства предполагает оценку рисков для здоровья при пожизненном непреднамеренном употреблении препарата и основывается на имеющихся исследованиях – доклинических, клинических, постмаркетинговых, фармаконадзора.
В странах Евросоюза токсикологическую оценку препаратов проводят опытные квалифицированные токсикологи, которые определяют риски и предельные уровни воздействия веществ на здоровье. Однако, отечественная фармацевтическая отрасль оказалась не готова к внедрению этого требования, в основном по причине отсутствия подготовленных специалистов. Ускоренных курсов обучения по данному направлению нет, поэтому хороших специалистов крайне мало во всем мире. Несмотря на это, «Р-Фарм» удалось одним из первых на российском рынке организовать проведение токсикологической оценки лекарственных средств. Было создано новое структурное подразделение – группа токсикологии GMP-процессов в составе дирекции по качеству. Первое время токсикологическую оценку препаратов заказывали у зарубежных специалистов-токсикологов, но достаточно быстро сотрудникам подразделения удалось освоить алгоритм проведения токсикологической оценки и методику расчета токсикологических характеристик, описанную в руководстве ЕМА «Guideline on setting health based exposure limits for use in risk identification in the manufacture of different medicinal products in shared facilities». В июле 2020 года перевод документа вступил в силу как Решение Коллегии Евразийской экономической комиссии от 14.01.2020 № 1 «Об утверждении Руководства по установлению допустимых пределов воздействия на здоровье в целях идентификации рисков при производстве лекарственных средств на общих производственных (технологических) линиях».
В настоящее время токсикологическая оценка лекарственных средств проводится специалистами «Р-Фарм» самостоятельно, и этот успешный опыт лег в основу ряда обучающих семинаров, которые ФБУ «Государственный институт лекарственных средств и надлежащих практик» проводит совместно с сотрудниками дирекции по качеству «Р-Фарм». Директор по качеству «Р-Фарм» Татьяна Вязьмина считает, что токсикология GMP – это новое направление токсикологии, которое только предстоит развивать в нашей стране. Крайне важно постоянно отслеживать и анализировать обновляющуюся информацию о лекарственных препаратах, чтобы своевременно вносить изменения в организацию производства. В России сообщество компетентных в GMP токсикологов только формируется, и эта профессия имеет хорошие перспективы. Вопросы, касающиеся токсикологической оценки, можно задать специалистам в рамках V Всероссийской GMP-конференции, на которой будут присутствовать ведущие эксперты разных направлений.
В вопросах совмещения производства препаратов на одних и тех же технологических линиях могут учитываться следующие документы:
- Решение Совета Евразийской экономической комиссии от 03.11.2016 № 77 «Об утверждении Правил надлежащей производственной практики Евразийского экономического союза»
- Приказ Минпромторга России от 14.06.2013 № 916 «Об утверждении Правил надлежащей производственной практики»
- Постановление Правительства РФ от 06.07.2012 № 686 «Об утверждении Положения о лицензировании производства лекарственных средств»
- Европейские требования Good Manufacturing Practice (GMP) European Medicines Agency (EMA)